Неинвазивные глюкометры. Спектрофотометрический сенсор хлорофилла
Набор для практики
Вопросы для самопроверки
- Что такое "глюкометр"?
- Почему так важна задача создания неинвазивных оптических глюкометров?
- Объясните разницу между концентрацией глюкозы в ткани, например, пальца человеческого тела и КГК.
- Что означает приставка "окклюзионный" в названии "окклюзионный спектрофотометрический глюкометр"?
- Каким образом в окклюзионном спектрофотометрическом глюкометре удается корректно пересчитать измеряемую концентрацию глюкозы в тканях пальца на концентрацию глюкозы в крови?
- Зачем нужно измерять содержание хлорофилла в листьях растений? Как его измеряли раньше?
- Что мешает спектрофотометрическому измерению концентрации хлорофилла непосредственно в листьях растений?
- Каков принцип неинвазивного спектрофотометрического измерения концентрации хлорофилла в листьях растений?
Упражнения
Упражнение 20.1. Дайте ответы на некоторые вопросы, касающиеся спектрофотометрического метода неинвазивного определения концентрации глюкозы в крови человека.
Вариант 1. Почему видимая область спектра не пригодна для неинвазивного спектрофотометрического определения концентрации глюкозы в крови человека?
Вариант 2. Что такое "окна прозрачности" воды и какое значение они имеют для неинвазивного спектрофотометрического определения концентрации глюкозы в крови человека?
Вариант 3. Какая фирма первой разработала экспериментальный образец сенсора для неинвазивного спектрофотометрического определения концентрации глюкозы в крови человека? Назовите основные принципы, положенные в основу его работы, и результаты, которые удалось достичь.
Вариант 4. Что такое "дифференциальный спектр поглощения" глюкозы? Почему в нем допустимы отрицательные значения?
Вариант 5. Что собой представляет единица измерения "  "? Если в дифференциальном спектре поглощения 5-милимолярного раствора глюкозы толщиной 1 мм разность оптической плотности
"? Если в дифференциальном спектре поглощения 5-милимолярного раствора глюкозы толщиной 1 мм разность оптической плотности  , то каков при этой длине волны молярный коэффициент поглощения глюкозы?
, то каков при этой длине волны молярный коэффициент поглощения глюкозы?
Вариант 6. Что имели в виду фирмы Foviopitics Inc. и Visionary Medical Products, сообщая о разработке спектрофотометрического сенсора глюкозы, использующего "естественное окно для доступа света к крови"?
Вариант 7. Что такое "термоэмиссионная спектрофотометрия" и как её пытаются использовать для неинвазивного спектрофотометрического определения концентрации глюкозы в крови человека?
Упражнение 20.2. Дайте ответы на некоторые вопросы и сделайте расчеты, касающиеся окклюзионного спектрофотометрического метода неинвазивного определения концентрации глюкозы в крови человека.
Вариант 1. Опишите вкратце устройство окклюзионного спектрофотометрического глюкометра.
Вариант 2. Какой спектрофотометрический метод применяется в нем для определения концентрации глюкозы в ткани? Может ли быть применен и другой метод?
Вариант 3. Опишите вкратце принцип определения разности между фактическими уровнями кровенаполнения пальца.
Вариант 4. Рассчитайте отношение спектральных интенсивностей прошедшего сквозь ткани пальца света при разных уровнях кровенаполнения на длине волны, характерной для поглощения глюкозой, если концентрации воды, гемоглобина и глюкозы в крови 850 г/л, 130 г/л и 4,1 ммоль/л соответственно. Удельные коэффициенты поглощения воды, гемоглобина и глюкозы на длине волны, характерной для поглощения глюкозой, соответственно 9x10–4 л/(гxмм), 1,5x10–3 л/(гxмм) и 0,18 л/(мольxмм). Среднестатистическая длина пути света в ткани пальца 7 мм. Разность между уровнями кровенаполнения 3,6%. Рассчитайте также отношение спектральных интенсивностей, связанное только с изменением концентрации глюкозы, обусловленным приливом крови в ткань.
Вариант 5. Рассчитайте отношение спектральных интенсивностей обратно рассеянного тканями пальца света на длине волны, характерной для поглощения глюкозой, используя данные, приведенные в варианте 4. Но среднестатистическую длину пути света в тканях пальца примите равной 8 мм. Рассчитайте также отношение спектральных интенсивностей, связанное только с изменением концентрации глюкозы, обусловленным приливом крови в ткань.
Вариант 6. Объясните вкратце, с чем связаны неудачи многих разработок неивазивного спектрофотометрического сенсора глюкозы.
Упражнение 20.3. Дайте ответы на некоторые вопросы или сделайте расчеты, касающиеся спектрофотометрического сенсора для измерения содержания хлорофилла в листьях растений.
Вариант 1. Как устроен спектрофотометрический сенсор для измерения содержания хлорофилла в листьях растений?
Вариант 2. По какому критерию выбирают длину волны света, используемого для измерения содержания хлорофилла в листьях растений?
Вариант 3. Вычислите отношение интенсивностей красного света, прошедшего сквозь сосудистую сеть листка и сквозь пластинки с хлоропластами, если концентрация хлорофилла в них составляет 3 мг/см2. Принять, что  и
и 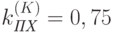 см2/мг.
см2/мг.
Вариант 4. Вычислите отношение интенсивностей красного света, прошедшего сквозь сосудистую сеть листка и сквозь пластинки с хлоропластами, если концентрация хлорофилла в них составляет 6 мг/см2. Принять, что  и
и 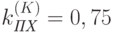 см2/мг.
см2/мг.
Вариант 5. Вычислите отношение интенсивностей красного света, прошедшего сквозь сосудистую сеть листка и сквозь пластинки с хлоропластами, если концентрация хлорофилла в них составляет 1,5 мг/см2. Принять, что  и
и 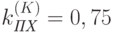 см2/мг.
см2/мг.
Вариант 6. Вычислите отношение спектральных интенсивностей красного и БИК света, прошедших сквозь лист растения, если концентрация хлорофилла в нём составляет 4 мг/см2. Принять, что  и
и 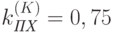 см2/мг.
см2/мг.
Вариант 7. Вычислите отношение спектральных интенсивностей красного и БИК света, прошедших сквозь лист растения, если относительная площадь пластинок с хлоропластами  . Концентрация хлорофилла в них 4 мг/см2;
. Концентрация хлорофилла в них 4 мг/см2; 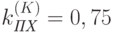 см2/мг.
см2/мг.
Вариант 8. Вычислите концентрацию хлорофилла в листке растения, если отношение спектральных интенсивностей красного и БИК света, прошедших сквозь лист растения, составляет 1:9. Принять, что  и
и 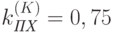 см2/мг.
см2/мг.
Ответы
Ответы на вопросы
1. Глюкометрами называют сенсоры для измерения содержания глюкозы в крови человека. Иногда их называют также "приборами для измерения сахара крови".
2. В мире уже около 200 млн. людей болеют диабетом. Эта болезнь на сегодня, к сожалению, считается неизлечимой и сопровождает человека всю жизнь. Во избежание тяжелых осложнений заболевшие диабетом люди должны придерживаться специального режима жизни и питания и периодически проверять свою кровь "на сахар". Неинвазивный оптический глюкометр позволил бы миллионам диабетиков избавиться от частого травмирования тела для отбора проб крови и от связанного с этим риска заражений.
3. Концентрация глюкозы в ткани, например, пальца человеческого тела – это количество (в молях) молекул глюкозы, приходящихся на единицу объёма ткани. А КГК (концентрация глюкозы в крови) – это количество (в молях) молекул глюкозы, приходящихся на единицу объёма крови. Поскольку кровь занимает лишь несколько процентов объема ткани, то концентрация глюкозы в ткани в десятки раз меньше, чем КГК.
4. Приставка "окклюзионный" в названии "окклюзионный спектрофотометрический глюкометр" означает, что для измерения КГК в этом сенсоре используется окклюзия – сдавливание кровеносных сосудов с помощью надувной манжеты. При этом существенно изменяется кровенаполнение исследуемого участка тела, например, пальца. И появляется возможность проведения измерений при разных значениях кровенаполнения. А это дает необходимую дополнительную информацию для корректного пересчета измеряемых концентраций глюкозы в ткани на КГК.
5. В окклюзионном спектрофотометрическом глюкометре корректно пересчитать измеряемую концентрацию глюкозы в ткани пальца на концентрацию глюкозы в крови удается благодаря тому, что концентрация глюкозы в ткани измеряется при разных уровнях кровенаполнения пальца. А разница между фактическими уровнями кровенаполнения определяется по измерениям концентрации гемоглобина.
6. Содержание хлорофилла в листьях растений – это важный показатель развития и функционирования растения. В молодых листочках поверхностная плотность хлорофилла невелика, но со временем возрастает. Чем больше она становится, тем быстрей повышается производительность процессов фотосинтеза и скорость наращивания биомассы растения. Специалисты по физиологии растений и агрономы-практики могут сделать по этому показателю ряд важных выводов и, если требуется, своевременно принять соответствующие агротехнические меры. Раньше для определения этого параметра из листьев растения пустотелой трубочкой стандартного диаметра делали "высечки" фиксированной площади, растирали их, готовили спиртовую вытяжку хлорофилла, заливали ее в кюветы и определяли спектрофотометрическим методом концентрацию хлорофилла в растворе. Полученное значение пересчитывали в поверхностную плотность с учетом известной площади высечки.
7. Спектрофотометрическому измерению концентрации хлорофилла непосредственно в листьях растений мешает то, что пластина листка пронизана сосудистой сетью. Поглощение света сосудами и протекающими по ним растворами намного меньше, чем поглощение его участками с хлоропластами. И поэтому в световой поток, проникающий сквозь лист растения, значительный вклад вносит свет, прошедший сквозь сосудистую систему листка, где хлорофилла практически нет.
8. Принцип неинвазивного спектрофотометрического измерения концентрации хлорофилла в листьях растений заключается в следующем. Выбирают две сравнительно близкие длины волны: одну в красной области спектра, где хлорофилл имеет сильную полосу поглощения, другую – в ближней инфракрасной области спектра, где поглощение хлорофилла уже незначительное. В то же время коэффициенты фонового поглощения и рассеяния света на обеих длинах волны приблизительно одинаковы. Беря отношение измеряемых на указанных длинах волн спектральных интенсивностей прошедшего сквозь листок света, можно вычислить концентрацию хлорофилла.
Ответы к упражнениям
Упражнение 20.1.
Вариант 1. Видимая область спектра не подходит для неинвазивного спектрофотометрического определения концентрации глюкозы в крови человека потому, что глюкоза в этой области прозрачна, т.е. практически не поглощает свет.
Вариант 2. В биологической ткани всегда в большом количестве присутствует вода, которая сильно поглощает инфракрасный свет. Она и является поэтому главным препятствием в этой спектральной области. Однако оказалась, что в некоторых спектральных интервалах поглощение воды слабое. Эти спектральные интервалы и называют спектральными "окнами прозрачности". Первый такой интервал простирается от видимой области спектра до длины волны до 1,35 мкм, второй – от 1,55 до 1,85 мкм и третий – от 2,1 до 2,3 мкм. Для неинвазивного спектрофотометрического определения концентрации глюкозы в крови человека потенциально могут быть использованы только эти "окна".
Вариант 3. Экспериментальный образец сенсора для неинвазивного спектрофотометрического определения концентрации глюкозы в крови человека первой разработала фирма Futrex Inc. (США). Для измерений они просвечивали ближним ИК светом с непрерывным спектром палец руки. Свет, прошедший сквозь палец, разлагался в спектр, и измерялись спектральные интенсивности этого света на нескольких длинах волны. В БИК области до 1,8 мкм были отобраны спектральные интервалы, характерные для поглощения света глюкозой и для поглощения другими, "фоновыми" веществами тела (вода, жиры, гемоглобин и другие белки). Для расчета концентрации глюкозы применялись методики многоволновой спектрофотометрии, чтобы можно было выделить вклад и определить относительно небольшую концентрацию именно глюкозы. Разработчикам удалось улавливать и измерять малые концентрации глюкозы на уровне 100 мг% в кюветах с калиброванными растворами глюкозы и фоновых веществ. Был создан и выпущен во многих экземплярах для испытаний экспериментальный образец.
Вариант 4. "Дифференциальный спектр поглощения" глюкозы – это зависимость от длины волны разности оптических плотностей 1 мм слоя раствора глюкозы и чистой воды:  . При тех длинах волны, при которых раствор глюкозы поглощает свет сильней, чем вода,
. При тех длинах волны, при которых раствор глюкозы поглощает свет сильней, чем вода,  . А там, где поглощение раствора глюкозы слабей, чем поглощение чистой воды, имеем
. А там, где поглощение раствора глюкозы слабей, чем поглощение чистой воды, имеем 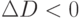 .
.
Вариант 5. Единица измерения "  " является производной от единицы измерения оптической плотности
" является производной от единицы измерения оптической плотности  ( A bsorpbance U nity). Это оптическая плотность такого слоя, при которой десятичный логарифм пропускания слоя
( A bsorpbance U nity). Это оптическая плотность такого слоя, при которой десятичный логарифм пропускания слоя  , т.е. свет ослабляется таким слоем в 10 раз. Единица
, т.е. свет ослабляется таким слоем в 10 раз. Единица 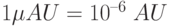 . По формуле (18.7)
. По формуле (18.7)  . Отсюда находим
. Отсюда находим  . Подставляя в это выражение значения
. Подставляя в это выражение значения  и
и 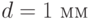 , находим
, находим  .
.
Вариант 6. Сообщая о разработке спектрофотометрического сенсора глюкозы, использующего "естественное окно для доступа света к крови", фирмы Foviopitics Inc. и Visionary Medical Products имели в виду человеческий глаз. Речь идет о зондировании светом определенных длин волны, измерении и анализе спектральных интенсивностей света, отраженного от богатой кровеносными сосудами сетчатки глаза. Ведь поглощение света хрусталиком и стекловидным телом глаза невелико и не специфично. Основное поглощение и изменение спектрального состава света происходят именно в сетчатке глаза и определяются составом циркулирующей там крови.
Вариант 7. "Термоэмиссионная спектрофотометрия" – это метод спектрофотометрии, при котором для измерений используется не внешний свет, а собственное инфракрасное тепловое излучение самой биоткани. В области длин волны от 8 до 14 мкм (средняя ИК область спектра) были выявлены характерные полосы теплового излучения глюкозы при 9,6 мкм и 10,9 мкм. Используя возможности микроминиатюризации, разработчикам удалось вместить чувствительную часть прибора в габариты крохотной капсулы. Ее вставляют пациенту в слуховой канал уха и измеряют тепловое излучение на указанных длинах волны от барабанной перепонки, которая считается одной из наиболее термостабильных частей человеческого тела. Чем больше концентрация глюкозы в крови, тем больше её концентрация и в барабанной перепонке. Тем больше интенсивность ИК излучения на указанных длинах волны.
Упражнение 20.2.
Вариант 1. Одним из узлов окклюзионного спектрофотометрического глюкометра является измерительное ложе для пальца. В него встроено надувное резиновое кольцо-манжета, сквозь которое человек вставляет свой палец. Пучка пальца ложится в углубление и входит в оптический контакт с выведенными к поверхности углубления торцами оптических волокон, через которые передаются зондирующие световые импульсы и отбираются пучки обратно рассеянного пальцем света для измерений. Зондирующие пучки света излучаются светодиодами, управляемыми модулятором. Измеряемые пучки света поступают на узел приема световых сигналов, который усиливает их, демодулирует, преобразует в цифровые коды, пропорциональные спектральным интенсивностям, и передает в микропроцессор. Микропроцессор управляет всем процессом измерений и выполняет все необходимые математические расчеты. Он же с использованием мини-компрессора, манометра и двухходового вентиля управляет и давлением воздуха в кольце-манжете и, соответственно, кровенаполнением пальца. В состав окклюзионного спектрофотометрического глюкометра входят также клавиатура управления, дисплей для отображения информации, волоконно-оптические световоды и узел связи с внешним компьютером или информационной сетью.
Вариант 2. Для определения концентрации глюкозы в ткани в окклюзионном спектрофотометрическом глюкометре применяется метод двухволновой спектрофотометрии в прошедшем сквозь палец свете. Для этого в палец через оптическое волокно с малой угловой апертурой вводят узкий зондирующий пучок света перпендикулярно к поверхности кожи. На противоположном конце мягких тканей пальца с помощью другого оптического волокна отбирают только пучок, выходящий на фиксированном расстоянии от точки облучения тоже перпендикулярно поверхности кожи. Благодаря этому в измерении участвует только свет, прошедший в тканях пальца вдоль пучка наиболее вероятных траекторий.
Измерения выполняют в двух спектральных интервалах. Один из них выбран при длине волны 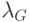 , характерной для поглощения глюкозой. В принципе, могут быть применены и более "мощные" методы спектрофотометрии – многоволновая и непрерывная, когда измеряются и участвуют в расчетах спектральные интенсивности обратно рассеянного света на многих длинах волн или весь непрерывный спектр в заданных спектральных полосах.
, характерной для поглощения глюкозой. В принципе, могут быть применены и более "мощные" методы спектрофотометрии – многоволновая и непрерывная, когда измеряются и участвуют в расчетах спектральные интенсивности обратно рассеянного света на многих длинах волн или весь непрерывный спектр в заданных спектральных полосах.
Вариант 3. Для определения разности между фактическими уровнями кровенаполнения пальца используются параллельные измерения концентрации гемоглобина в ткани пальца при тех же двух уровнях его кровенаполнения. Как было показано в предыдущей лекции, это тоже можно сделать с применением двухволновой спектрофотометрии. Для этого один из зондирующих пучков света должен иметь длину волны  , характерную для поглощения гемоглобином.
, характерную для поглощения гемоглобином.
Вариант 4. Для вычисления отношения спектральных интенсивностей прошедшего сквозь палец света на длине волны, характерной для поглощения света глюкозой, используем формулу (20.6). Сначала найдем значение показателя экспоненты: 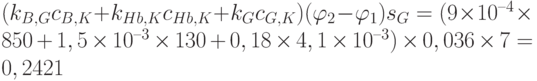 . В этом значении только слагаемое
. В этом значении только слагаемое  связано с изменением концентрации глюкозы, обусловленным приливом крови в ткань. Теперь можно вычислить соотношение спектральных интенсивностей:
связано с изменением концентрации глюкозы, обусловленным приливом крови в ткань. Теперь можно вычислить соотношение спектральных интенсивностей:  .
Это значит, что в результате прилива крови к пальцу спектральная интенсивность уменьшается приблизительно на 27%. Отношение спектральных интенсивностей, связанное с изменением именно концентрации глюкозы, обусловленным приливом крови в ткань, равна
.
Это значит, что в результате прилива крови к пальцу спектральная интенсивность уменьшается приблизительно на 27%. Отношение спектральных интенсивностей, связанное с изменением именно концентрации глюкозы, обусловленным приливом крови в ткань, равна  . Это значит, что только 0,02% изменения спектральной интенсивности связано с изменением концентрации глюкозы, а все остальное – с увеличением концентраций воды и гемоглобина, добавленных в ткань с приливом крови.
. Это значит, что только 0,02% изменения спектральной интенсивности связано с изменением концентрации глюкозы, а все остальное – с увеличением концентраций воды и гемоглобина, добавленных в ткань с приливом крови.
Вариант 5. Находим сначала значение показателя экспоненты:  . Соотношение спектральных интенсивностей:
. Соотношение спектральных интенсивностей:  . Это значит, что в результате прилива крови к пальцу спектральная интенсивность уменьшается приблизительно на 32%. В показателе экспоненты только слагаемое
. Это значит, что в результате прилива крови к пальцу спектральная интенсивность уменьшается приблизительно на 32%. В показателе экспоненты только слагаемое  связано с изменением концентрации глюкозы, обусловленным приливом крови в ткань. Связанное с этим изменение отношения спектральных интенсивностей равно
связано с изменением концентрации глюкозы, обусловленным приливом крови в ткань. Связанное с этим изменение отношения спектральных интенсивностей равно 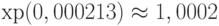 . Это значит, что только 0,02% изменения спектральной интенсивности связано с изменением концентрации глюкозы.
. Это значит, что только 0,02% изменения спектральной интенсивности связано с изменением концентрации глюкозы.
Вариант 6. Неудачи многих разработок неинвазивного спектрофотометрического сенсора глюкозы связаны с тем, что разработчики не понимали, не ставили и не решали задачу корректного пересчета измеряемой концентрации глюкозы в ткани на КГК. Однако главная причина заключается в том, что, во-первых, средняя концентрация глюкозы в биологических тканях очень мала (порядка 0,1 ммоль/л), – в десятки раз меньше, чем в крови. А во-вторых, глюкоза, к сожалению, не имеет сильных полос поглощения не только в видимой, но и во всей ближней ИК области спектра. И поэтому точно выделить очень слабое поглощение именно глюкозы из намного более сильного фонового поглощения десятков других веществ, присутствующих в биоткани, чрезвычайно сложно.
Упражнение 20.3.
Вариант 1. Спектрофотометрический сенсор для измерения содержания хлорофилла в листьях растений имеет оптоэлектронную головку, состоящую конструктивно из двух узлов. В одном из них размещены красный и инфракрасный светодиоды, а в другом – фотоприемник с усилителем. Листок, не отрывая от растения, вставляют между узлами головки и просвечивают поочередно красным и инфракрасным светом. По результатам измерений спектральных интенсивностей прошедшего света микрокомпьютер рассчитывает поверхностную концентрацию хлорофилла. Результаты сотен измерений могут сохраняться в долговременной памяти сенсора. В микрокомпьютере могут вычисляться средние значения по многим листьям одного растения, по открытой для света кроне или по затененным нижним листьям, среднее значение для группы однородных растений и т.п. Могут также вычисляться дисперсия и другие статистические величины, – всё, что нужно пользователю (агроному, биологу). Сенсор имеет также клавиатуру управления, встроенный дисплей, блок питания.
Вариант 2. Используется двухволновой метод спектрофотометрии "на просвет". Одну длину волны света выбирают в полосе сильного поглощения хлорофилла, обычно в красной области спектра. Вторую длину волны выбирают там, где поглощение хлорофилла уже слабое, а ослабление света из-за рассеяния и фонового поглощения еще такое же, как в красной области спектра. Обычно это ближняя ИК область. Благодаря такому выбору удается выделить потери света именно в хлоропластах листочка и рассчитать поверхностную концентрацию в них хлорофилла.
Вариант 3. Опираясь на формулу (20.20), для красного света, прошедшего сквозь сосудистую сеть листка, можно записать:  . А для прошедшего сквозь пластинки с хлоропластами,
. А для прошедшего сквозь пластинки с хлоропластами,  . Отношение этих интенсивностей
. Отношение этих интенсивностей ![I_C^{(K)}/I_X^{(K)}=[(1-\alpha)/\alpha]\exp(k_{\textit{ПХ}}^{(K)}c_{\textit{П}})](/sites/default/files/tex_cache/eb2ff723e4a222c63bb5a46ff7a66b59.png) . Подставляя данные задачи, находим:
. Подставляя данные задачи, находим: ![I_C^{(K)}/I_X^{(K)}[(1-0,9)/0,9]\exp(0,75\times 3) \approx 1](/sites/default/files/tex_cache/23422acee05e0744ae24fa2fb3b5bec1.png) .
.
Вариант 4. Используя формулу, выведенную в варианте 3, и подставляя в неё данные задачи, находим: ![I_C^{(K)}/I_X^{(K)}=[(1-0,9)/0,9]\exp(0,75\times 6) \approx 10](/sites/default/files/tex_cache/aab57936e5de01cd032029886c23fe8d.png) .
.
Вариант 5. Используя формулу, выведенную в варианте 3, и подставляя данные задачи, находим: ![I_C^{(K)}/I_X^{(K)}=[(1-0,9)/0,9]\exp(0,75\times 1,5) \approx 0,34](/sites/default/files/tex_cache/197af69de0bdbdb0a0a080244548f59e.png) .
.
Вариант 6. Используя формулу (20.22) и подставляя в неё данные задачи, находим:  .
.
Вариант 7. Используя формулу (20.22) и подставляя в неё данные задачи, находим:  .
.
Вариант 8. Используя формулу (20.23) и подставляя в неё данные задачи, находим: ![c_{\textit{П}}=\ln[0,9\times 9/(1-9(1-0,9))]/0,75](/sites/default/files/tex_cache/c2cacdee366ac8c191e9e0e8e9b44b75.png) = 5,86 мг/см2 .
= 5,86 мг/см2 .
