Неинвазивные глюкометры. Спектрофотометрический сенсор хлорофилла
20.2. Сенсор для измерения хлорофилла в листьях растений
Поучительным специфическим примером спектрофотометрического сенсора, благодаря особенностям объекта исследования, является сенсор для измерения содержания хлорофилла в листьях растений. Речь идет о среднем количестве хлорофилла, которое приходится на единицу площади зеленого листка растения и измеряется в мг/см2. Для специалистов по физиологии растений и агрономов-практиков это – очень важный показатель нормального развития и функционирования растения. В молодых листочках поверхностная плотность хлорофилла невелика, но со временем возрастает. Чем больше она становится, тем быстрей повышается производительность процессов фотосинтеза и скорость наращивания биомассы растения. Специалисты по физиологии растений и агрономы-практики могут сделать по этому показателю ряд важных выводов, и если требуется, своевременно принять соответствующие агротехнические меры.
Классический метод определения этого параметра состоит в том, что из листьев растения пустотелой трубочкой стандартного диаметра делают "высечки" фиксированной площади, растирают их, готовят спиртовую вытяжку хлорофилла, заливают ее в кюветы и спектрофотометрическим методом определяют концентрацию хлорофилла в растворе. Полученное значение пересчитывают в поверхностную плотность с учетом известной площади высечки.

Рис. 20.5. Вид одного из участков зеленого листка при 30-кратном увеличении: а) фотография; б) схема на просвет; в) схема в разрезе
Мы видим сеть сосудов, в промежутках между которыми размещаются пластинки с хлоропластами. Стенки сосудов и находящаяся в них жидкость поглощают свет значительно меньше, чем хлоропласты, и потому пропускают больше света и выглядят значительно светлее. Хлоропласты поглощают свет сильнее, поэтому выглядят темными.
Интенсивность света, который проходит сквозь хлоропласты, может быть вычислена по известной формуле
 |
( 20.16) |
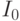 – интенсивность падающего света;
– интенсивность падающего света; 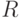 – коэффициент отражения от поверхности листка;
– коэффициент отражения от поверхности листка;  – коэффициент ослабления света в хлоропласте (мм–1);
– коэффициент ослабления света в хлоропласте (мм–1); 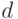 – толщина хлоропласта (листка).
– толщина хлоропласта (листка).При прохождении сквозь хлоропласт свет ослабляется как из-за поглощения, так и вследствие рассеяния на оптических неоднородностях. Поэтому
 |
( 20.17) |
 – удельный коэффициент поглощения света хлорофиллом;
– удельный коэффициент поглощения света хлорофиллом; 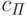 – поверхностная концентрация хлорофилла, которую и нужно определять;
– поверхностная концентрация хлорофилла, которую и нужно определять;  – коэффициент ослабления света из-за рассеяния и фонового поглощения всеми другими компонентами ткани листка, кроме хлорофилла. Этот коэффициент не зависит от концентрации хлорофилла.
– коэффициент ослабления света из-за рассеяния и фонового поглощения всеми другими компонентами ткани листка, кроме хлорофилла. Этот коэффициент не зависит от концентрации хлорофилла.Интенсивность света, который проходит сквозь светлые места листка (сквозь его сосудистую сеть), может быть вычислена по формуле
 |
( 20.18) |
Интенсивность эта, как правило, на порядок превышает интенсивность света, проникающего сквозь темные участки листка. И хотя суммарная площадь темных участков в 6...20 раз больше, чем суммарная площадь светлых участков, интегральный (по всей площади) световой поток, который проходит сквозь светлые участки, вполне сопоставим с интегральным световым потоком, проникающим сквозь темные участки листка. А при больших концентрациях хлорофилла световой поток сквозь светлые участки в синей области спектра может стать определяющим.
Участки с хлоропластами перекрывают часть  всей поверхности листка. Размеры этих участков значительно меньше размера области диаметром 3-5 мм, которую обычно просвечивает световой зонд. Поэтому при вычислении интенсивности суммарного светового потока
всей поверхности листка. Размеры этих участков значительно меньше размера области диаметром 3-5 мм, которую обычно просвечивает световой зонд. Поэтому при вычислении интенсивности суммарного светового потока  , проникающего сквозь листок, можно применить статистический подход. Тогда приходим к формуле
, проникающего сквозь листок, можно применить статистический подход. Тогда приходим к формуле
![I_{\textit{Л}}=I_0(1-R)[\alpha\exp(-k_{\textit{ПХ}}c_{\textit{П}}-K_{\textit{РФП}}d)+(1-\alpha)\exp(-K_{\textit{РФП}}d)].](/sites/default/files/tex_cache/b1868b243a3e882eda75ac885629ecc6.png) |
( 20.19) |
Первое слагаемое в квадратных скобках соответствует световому потоку сквозь пластинки с хлоропластами, а второе – световому потоку сквозь сосудистую сеть листка. Параметры 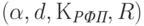 изменяются от листка к листку, от одного вида растений к другому, с возрастом листка. Поэтому, измерив только суммарный световой поток
изменяются от листка к листку, от одного вида растений к другому, с возрастом листка. Поэтому, измерив только суммарный световой поток  , прошедший сквозь листок, нельзя однозначно определить поверхностную концентрацию хлорофилла
, прошедший сквозь листок, нельзя однозначно определить поверхностную концентрацию хлорофилла 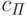 , которая интересует растениеводов.
, которая интересует растениеводов.
У связи с этим применяется особый подход [ [ 280 ] ]. Выберем две длины волны: одну в красной области спектра, где хлорофилл имеет сильную полосу поглощения, другую – в ближней инфракрасной области спектра, где поглощение хлорофилла уже незначительное. В то же время коэффициенты фонового поглощения и рассеяние света на обеих длинах волны приблизительно одинаковы. Для красной (измерительной) длины волны формулу (20.19) можно записать в виде
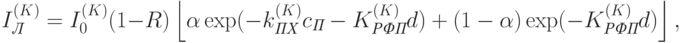 |
( 20.20) |
 и
и  – соответственно удельный коэффициент поглощения света хлорофиллом и фоновый коэффициент ослабления света другими компонентами ткани листка в красном интервале спектра;
– соответственно удельный коэффициент поглощения света хлорофиллом и фоновый коэффициент ослабления света другими компонентами ткани листка в красном интервале спектра;  – интенсивность первичного пучка красного света.
– интенсивность первичного пучка красного света.Для инфракрасной (опорной) длины волны, где поглощение хлорофилла слабо и практически не отличается от фона, формулу (20.19) можно записать в виде
 |
( 20.21) |
 – фоновый коэффициент ослабления света в инфракрасном интервале спектра;
– фоновый коэффициент ослабления света в инфракрасном интервале спектра;  – интенсивность первичного пучка инфракрасного света.
– интенсивность первичного пучка инфракрасного света.Если 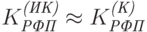 , то выравнивая (соответствующим регулированием тока через светодиоды) интенсивности падающего света в обоих каналах, мы можем добиться, чтобы выполнялось условие
, то выравнивая (соответствующим регулированием тока через светодиоды) интенсивности падающего света в обоих каналах, мы можем добиться, чтобы выполнялось условие  . Тогда, поделив равенство (20.20) на равенство (20.21), получаем
. Тогда, поделив равенство (20.20) на равенство (20.21), получаем
 |
( 20.22) |
Решая это уравнение относительно поверхностной концентрации хлорофилла, находим:
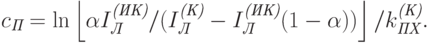 |
( 20.23) |
Итак, измеряя интенсивности красного и инфракрасного света, прошедших сквозь листок, и зная параметры  и
и  , можно по формуле (20.23) рассчитать поверхностную концентрацию хлорофилла.
, можно по формуле (20.23) рассчитать поверхностную концентрацию хлорофилла.
Относительная доля  площади листка, которую занимают "темные" участки с хлоропластами, зависит, вообще говоря, от вида растений и от возраста листьев. Но в среднем можно принять значение
площади листка, которую занимают "темные" участки с хлоропластами, зависит, вообще говоря, от вида растений и от возраста листьев. Но в среднем можно принять значение  .
.
Поскольку в листьях присутствуют 2 формы хлорофилла ( 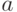 и
и 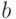 ), которые поглощают свет несколько по-разному (
рис.
20.6), то для определения концентрации общего хлорофилла длину волны лучше выбрать там, где обе формы поглощают свет одинаково, например, при
), которые поглощают свет несколько по-разному (
рис.
20.6), то для определения концентрации общего хлорофилла длину волны лучше выбрать там, где обе формы поглощают свет одинаково, например, при  .
.
Структура выносной оптоэлектронной головки сенсора показана на рис. 20.7. Головка выполнена в виде клипсы (прищепки) и содержит в одной щечке (2) красный (4) и инфракрасный (5) светодиоды, а в другой щечке (3) – фотоприемник 6. Листок 1, не отрывая от растения, вставляют между щечками клипсы, просвечивают поочередно красным и инфракрасным светом.
По результатам измерений микрокомпьютер рассчитывает поверхностную концентрацию хлорофилла. Результаты сотен измерений могут сохраняться в долговременной памяти сенсора. В микрокомпьютере могут вычисляться средние значения по многим листьям одного растения, по открытой для света кроне или по затененным нижним листьям, среднее значение для группы однородных растений и т.п. Могут также вычисляться дисперсия и другие статистические величины, – всё, что нужно пользователю (агроному, биологу).

Рис. 20.7. Вверху – конструкция оптоэлектронной головки для определения плотности хлорофилла в листьях растений; внизу – головка в действии
Подобный интеллектуальный спектрофотометрический сенсор CCM-200 (Chlorophyll Content Meter – см. рис. 20.8) выпустила на рынок также американская фирма Opti-Sciences [http://www.optisci.com/ccm.htm]. Оптоэлектронный узел здесь не является выносным, а встроен в корпус сенсора. Головка с фотоприемником и встроенным усилителем сделана подвижной. Исследуемую часть листка вставляют между головкой и расположенными в корпусе светодиодами, прижимают головкой. После этого выполняются измерения и вычисление концентрации хлорофилла. Одновременно отсчитывается координата головки по вертикали, что позволяет определить толщину листка. Это позволяет вычислить не только поверхностную, но и объемную среднюю концентрацию хлорофилла.

Рис. 20.8. Сенсор для измерения содержания хлорофилла в листьях растений фирмы Opti-Sciences (США). Размеры 152 х 82 х 25 мм, масса 162 г
Сенсор размерами 152x82x25 мм и массой 162 г имеет память на 8000 измерений, встроенный аккумулятор электропитания, рассчитан на длительное применение в полевых условиях. К нему прилагаются кабель интерфейса RS-232 и программное обеспечение для организации считывания накопленных в нем данных во внешний компьютер.
Краткие итоги
Уже в 70-х годах ХХ в. одной из важных задач стала необходимость создания сенсора для неинвазивного измерения концентрации глюкозы в крови (КГК). Наибольшие надежды при этом возлагались именно на спектрофотометрические сенсоры. Было предпринято много попыток создания неинвазивных спектрофотометрических глюкометров с использованием методов многоволновой и непрерывной спектрофотометрии. Долгое время разработчики не осознавали разницу между КГК и концентрацией глюкозы в просвечиваемых тканях. В начале ХХI в. предложена идея окклюзионного спектрофотометрического глюкометра, которая, благодаря измерениям при разных уровнях кровенаполнения просвечиваемого участка тела, успешно решает проблему корректного пересчета результатов измерений спектральных интенсивностей на КГК. И тем не менее, создать и выпустить на рынок неинвазивный спектрофотометрический глюкометр пока не удалось из-за того, что не только в видимой, но и в доступной ИК области спектра молекулы глюкозы не имеют сильных специфических полос поглощения. К тому же средняя концентрация глюкозы в тканях тела в 20-100 раз меньше её концентрации в крови и составляет лишь порядка 10–5 - 10–4 моль/л.
Интересным примером спектрофотометрического сенсора, благодаря особенностям объекта исследования, является сенсор для измерения содержания хлорофилла в листьях растений. Препятствием здесь стала гетерогенная структура листовой пластинки. Лист всегда пронизан сосудистой сетью, которая поглощает свет значительно слабей, чем хлоропласты, и потому пропускает больше света и выглядит на просвет значительно светлее. И хотя суммарная площадь темных участков гораздо больше, чем суммарная площадь светлых участков, интегральный (по всей площади листка) световой поток, который проходит сквозь светлые участки, вполне сопоставим со световым потоком, проникающим сквозь темные участки листка. Однако внимательный количественный анализ позволил всё же найти способ не травмирующего лист растения спектрофотометрического измерения содержания хлорофилла. Такие интеллектуальные сенсоры уже выпускаются промышленно. Специалисты по физиологии растений и агрономы-практики могут сделать по этому показателю ряд важных выводов, и если требуется, своевременно принять соответствующие агротехнические меры.

