| Россия |
Химически чувствительные полевые транзисторы и биосенсоры на их основе. Кондуктометрические и амперометрические сенсоры
16.4. Амперометрические и кулонометрические сенсоры
16.4.1. Принцип действия
Если к электродам электрохимического элемента приложить внешнее напряжение, превышающее величину их электродного потенциала, то динамическое равновесие между прямыми и обратными химическими реакциями возле электродов нарушается, и через элемент начинает течь электрический ток. Сначала этот ток быстро уменьшается со временем ( рис. 16.4).

Рис. 16.4. Типичная временная зависимость тока через электрохимический элемент после подачи напряжения
Это обусловлено тем, что ионы, которые находятся вблизи электрода, сразу вступают в химическую реакцию, их концентрация здесь быстро уменьшается и становится значительно ниже, чем в основном объеме электролита. Из-за уменьшения концентрации ионов возле электрода уменьшаются скорость реакции и обусловленный ею электрический ток (поток электрических зарядов).
Возникающий вследствие обеднения прикатодной области градиент концентрации ионов в электролите и стимулирует диффузию ионов из объема к электроду. К этому добавляется также дрейф ионов под действием слабого электрического поля, возникающего в электролите. И со временем устанавливается новое динамическое равновесие, когда количество ионов, вступающих за единицу времени в химические реакции возле электродов, сравнивается с количеством ионов, которые подходят к электродам из объема электролита посредством диффузии и дрейфа. Электрический ток перестает изменяться. Этот стационарный электрический ток  пропорционален концентрации ионов в электролите. И измеряя его, после соответствующей калибровки сенсора, можно достаточно точно определять концентрацию ионов в исследуемом растворе.
пропорционален концентрации ионов в электролите. И измеряя его, после соответствующей калибровки сенсора, можно достаточно точно определять концентрацию ионов в исследуемом растворе.
16.4.2. Кислородный электрод Кларка
В качестве примера простого амперометрического сенсора рассмотрим предложенную Л. Кларком в середине ХХ в. конструкцию гальванического электрода для определения концентрации кислорода в окружающей среде ( рис. 16.5).
В пластмассовом цилиндрическом корпусе 1 сделаны сквозные отверстия для проводников, в которых размещены индикаторный (рабочий) электрод 2 из платины и электрод сравнения 3 из серебряных проволок, концы которых покрыты пастой из хлорида серебра. Нижний конец корпуса обтягивают газопроницаемой полимерной мембраной 4 из полипропилена (полиэтилена, фторопласта, целлофана и т.п.), которую механически фиксируют на корпусе с помощью резинового кольца 5. В пространство между электродами и мембраной залит водный раствор хлорида кальция 6. Извне мембрана 4 контактирует с контролируемой средой 7. Это может быть как жидкость, так и газ.
Если в контролируемой среде кислорода нет, то при подаче напряжения между электродом сравнения (анод) и рабочим электродом установившийся стационарный ток очень слаб. При наличии в контролируемой среде кислорода его молекулы диффундируют сквозь мембрану 4 и через раствор 6. Когда они достигают индикаторного электрода 2, то благодаря каталитическим свойствам платины здесь происходит реакция восстановления
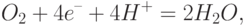 |
( 16.1) |
Стационарный ток линейно зависит от концентрации кислорода в контролируемой среде. Этим данный сенсор существенно отличается от потенциометрических газовых сенсоров, у которых разность электродных потенциалов зависит от концентрации газа логарифмически. Соответственно в амперометрических газовых сенсорах диапазон измеряемых концентраций более узок, чувствительность ниже, но точность определения концентрации в рабочем диапазоне выше. Рабочий диапазон измеряемых концентраций, кроме конструктивных факторов, можно регулировать также, изменяя величину приложенного напряжения.
16.4.3. Другие амперометрические сенсоры
Специально подбирая материал электродов, состав внутреннего электролита, электродное напряжение, удается построить амперометрические сенсоры подобной конструкции также для определения концентраций таких газов, как хлор, сероводород, серный газ, водород, угарный газ, окислы азота и т.д. Такие "готовые к применению" гальванические электроды уже выпускаются промышленно. На рис. 16.6 в качестве примера показаны 2 промышленно выпускаемых гальванических электрода.
Электрод слева – платиновый, помещен в стеклянный корпус с соответствующим гелем внутри и газопроницаемой мембраной. Имеет внешний вывод в виде кабеля длиной до 9 м. Используется для контроля воды в бассейнах, хроматных и др. растворов в промышленности. Гальванический электрод справа выполнен в эпоксидном корпусе длиной 110 мм, диаметром 12 мм и предназначен для измерения содержания кислорода в жидких средах.
Для повышения селективности амперометрических электрохимических сенсоров и расширения палитры контролируемых молекул-аналитов чаще всего используют катализаторы соответствующих химических реакций, в частности ферменты естественного происхождения. Рассмотрим один из первых амперометрических биосенсоров для определения концентрации глюкозы. С этой целью на газопроницаемую мембрану, отделяющую исследуемый раствор от окружающего воздуха, наносили полиакриламидный гель с иммобилизованной в нем глюкозооксидазой. В ее присутствии молекулы кислорода, проникающие сквозь газопроницаемую мембрану, реагируют с имеющейся в исследуемом растворе глюкозой:
 |
( 16.2) |
Молекулы перекиси водорода мигрируют к платиновому катоду, где восстанавливаются. Если растворенного в геле кислорода достаточно, то электрический ток, протекающий через такой электрохимический элемент, пропорционален концентрации глюкозы в контролируемом растворе.
Позже конструкция и способы функционирования амперометрических сенсоров глюкозы были значительно усовершенствованы [ [ 235 ] , [ 338 ] и др.]. Однако в основе их работы по-прежнему остается использование глюкозооксидазы. Это – доступный, недорогой фермент, который добывают из Aspergillus niger и который долго сохраняет свои свойства. Благодаря этому удалось создать и выпускать промышленно наборы одноразовых электрохимических "полосок" для анализов крови на глюкозу с гарантированным сроком использования до 1 года [ [ 146 ] ].
С применением холестириноксидазы созданы амперометрические сенсоры для определения содержания холестерина (важный показатель крови и продуктов питания, который влияет на риск возникновения и на ход заболевания атеросклерозом). С использованием лактатоксидазы или лактатгидрогеназы работают амперометрические сенсоры на лактат (важный для медиков показатель мышечной деятельности), с использованием салицилатгидроксилазы – сенсор на содержание аспирина, с использованием ацетилхолинестеразы – амперометрический сенсор на такие нейротоксины, как зарин, зоман,  и прочие.
и прочие.
С применением в качестве биоселекторов соответствующих дезоксирибонуклеиновых кислот (ДНК) созданы электрохимические биосенсоры для выявления ряда инфекционных и врожденных заболеваний [ [ 45 ] ].
Для точных амперометрических исследований и измерений часто используют трехэлектродную электрохимическую ячейку, включающую, кроме электродов, через которые протекает основной электрический ток, также 3-й электрод ("электрод сравнения"), необходимый для точного поддержания неизменным напряжения между рабочими электродами.
16.4.4. Кулонометрические сенсоры
Одним из вариантов амперометрических сенсоров являются кулонометрические сенсоры, в которых электрический ток, протекающий через электрохимический элемент, интегрируется в течение определенного промежутка времени, т.е. измеряется суммарный электрический заряд, протекающий через элемент. Это позволяет дополнительно отфильтровать случайные отклонения, повысить чувствительность сенсора, сократить время измерения и энергозатраты [ [ 206 ] ].
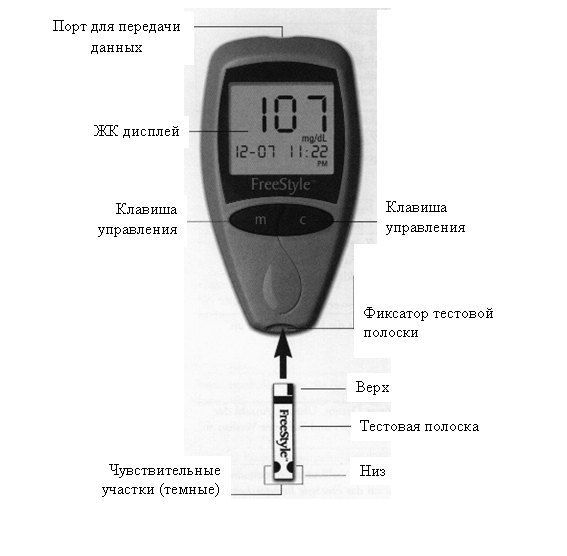
На рис. 16.7 для примера показан один из современных интеллектуальных кулонометрических сенсоров, предназначенный для повседневного измерения уровня сахара в крови человека. Его размеры 97x51x25 мм, масса вместе с батарейкой питания 58 г. Одной зарядки литиевой батарейки хватает на проведение 1000 измерений.
Для проведения измерения требуется мизерная капелька крови объёмом до 0,3 мкл, которую можно взять из любой части тела, и одноразовая тестовая полоска этой же фирмы. Каждая полоска представляет собой промышленно изготовленный миниатюрный электрохимический элемент с пористой матрицей для исследуемого электролита (крови) и печатными электродами, модифицированными ферментом глюкозооксидазой. В нижней части полоски темные полукруглые участки, которые соединены с матрицей для электролита системой капилляров. Вдоль этих капилляров кровь пациента под действием сил поверхностного натяжения автоматически втягивается в чувствительное аналитическое пространство между электродами. В верхней части тестовой полоски находятся внешние выводы электрохимического элемента. Для контакта с ними снизу в корпусе глюкометра предусмотрен фиксатор. Если тестовая полоска правильно вставлена в фиксатор, то глюкометр автоматически включается, и на его жидкокристаллическом дисплее высвечивается код тестовой полоски. Если он не совпадает с указанным на полоске, то с помощью клавиш управления надо установить нужный код. В комплекте глюкометра имеется ланцет "FreeStyle", который позволяет установить одно из пяти значений глубины прокалывания – в зависимости от намеченного места забора капли крови. Пружину ланцета легко взвести. Специальные насадки обеспечивают точность глубины прокалывания, которое происходит мгновенно и практически безболезненно. Каплю капиллярной крови, которая выступила в месте прокола, надо приложить к одному из полукруглых рабочих полей, не размазывая. Тестовая полоска (благодаря капиллярным силам) всасывает требуемое количество крови, о чем глюкометр извещает коротким звуковым сигналом. Кровь становится в приборе контролируемым раствором. Контактируя с глюкозооксидазой, глюкоза, имеющаяся в крови, окисляется. В электрохимическом элементе выделяется небольшое количество перекиси водорода, пропорциональное количеству имеющейся в крови глюкозы, и через элемент протекает пропорциональный этому количеству электрический заряд. Он измеряется сенсором, в микропроцессоре которого рассчитывается (с учетом кода полоски, найденных при калибровке констант и фактической температуры полоски) концентрация глюкозы в крови пациента. И через несколько секунд результат измерения выводится на дисплей. По выбору пользователя результат может выводиться в привычных для него единицах: в мг % (мг глюкозы на 1 дл крови) или в ммоль/л. Доступный для измерений диапазон концентраций составляет от 20 мг % до 500 мг % или от 1,1 ммоль/л до 27,8 ммоль/л. Сенсор автоматически запоминает дату, время и результат измерения, накапливает статистику (до 250 последних результатов), может выдавать статистические и детальные данные на дисплей или через порт передачи на внешний компьютер или в информационную сеть. При критических значениях концентрации глюкозы в крови сенсор выдает диагностические предупреждения о гипо- или гипергликемии и необходимости в связи с этим обратиться к врачу. В микропроцессор сенсора записаны также программы самодиагностики, калибровки с помощью контрольного раствора или эталонных тестовых полосок, настройки даты, времени, единиц измерения, громкости звуковых сигналов и т.п. С целью экономии энергии аккумуляторной батареи, заряда которой хватает приблизительно на 1000 измерений, сенсор, если он свыше 2 мин. не используется, автоматически выключается.
Ныне промышленно выпускаются и десятки других кулонометрических сенсоров глюкозы.