| Россия |
Принципы работы электрохимических сенсоров. Потенциометрические сенсоры
15.4.4. Газочувствительные потенциометрические сенсоры
С помощью электрохимических сенсоров можно обнаруживать и определять не только концентрацию ионов в растворах. Косвенно, по изменению концентрации ионов, с их помощью можно обнаруживать присутствие и концентрацию в контролируемой среде также ряда нейтральных молекул. Одним из примеров являются так называемые " газочувствительные электроды ". Принцип их действия показан на рис. 15.4.

Рис. 15.4. Структура газочувствительного электрохимического сенсора: М1 и М2 – внутренний и внешний металлические электроды; Е1 и Е2 – внутренний и внешний электролит; П – пористая перегородка; ГМ – газопроницаемая мембрана
Важным структурным элементом потенциометрического газочувствительного сенсора является мембрана ГМ, отделяющая электролит "внешнего" полуэлемента от окружающей атмосферы. Мембрана эта является непроницаемой для электролита, но проницаемой для молекул контролируемых газов. Чем выше концентрация таких газов в окружающей атмосфере, тем больше их молекул проникают через мембрану ГМ в электролит и растворяются в нем. Если они вступают в химические реакции, то сдвигают динамическое равновесие в приэлектродной зоне, вследствие чего изменяется разность потенциалов между электродами.
Например, в электрохимическом газовом сенсоре, настроенном на обнаружение аммиака ( 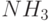 ) и на измерение его концентрации в окружающем воздухе, электролитом
) и на измерение его концентрации в окружающем воздухе, электролитом  является водный раствор хлорида аммония (
является водный раствор хлорида аммония (  ) высокой концентрации, а мембрана ГМ сделана проницаемой для молекул аммиака. Проникая сквозь мембрану ГМ и растворяясь в воде, молекула аммиака может реагировать с присутствующими в ней ионами водорода (
) высокой концентрации, а мембрана ГМ сделана проницаемой для молекул аммиака. Проникая сквозь мембрану ГМ и растворяясь в воде, молекула аммиака может реагировать с присутствующими в ней ионами водорода ( 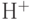 ) с образованием дополнительных ионов аммония:
) с образованием дополнительных ионов аммония:
 |
( 15.5) |
Эта химическая реакция приводит к увеличению концентрации ионов  и к уменьшению концентрации ионов
и к уменьшению концентрации ионов  в электролите, т.е. к изменению его
в электролите, т.е. к изменению его  . Дополнительно появившиеся ионы
. Дополнительно появившиеся ионы  в растворе высокой концентрации не оказывают большого влияния на суммарную концентрацию аммония. Поэтому основным показателем наличия аммиака в окружающем воздухе является изменение
в растворе высокой концентрации не оказывают большого влияния на суммарную концентрацию аммония. Поэтому основным показателем наличия аммиака в окружающем воздухе является изменение  раствора. Поэтому в качестве внутреннего в таком газовом сенсоре используют стеклянный -электрод. Расчет показывает, что изменение
раствора. Поэтому в качестве внутреннего в таком газовом сенсоре используют стеклянный -электрод. Расчет показывает, что изменение  раствора пропорционально логарифму концентрации аммиака.
раствора пропорционально логарифму концентрации аммиака.
Такой же внутренний электрод используют, например, в электрохимических газовых сенсорах на  (внешним электролитом в этом случае является
(внешним электролитом в этом случае является  , реакция при растворении:
, реакция при растворении: 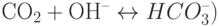 , в сенсорах на
, в сенсорах на  (внешним электролитом является
(внешним электролитом является  , реакция при растворении:
, реакция при растворении:  ) и в других.
) и в других.
В электрохимических газовых сенсорах на 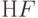 внутренним является фтор-селективный электрод, на
внутренним является фтор-селективный электрод, на  – соответственно
– соответственно  -селективный электрод и т.д.
-селективный электрод и т.д.
Одним из примеров интеллектуальных электрохимических газовых сенсоров является персональный газоанализатор ПГА-300 ( рис. 15.5, а ), предназначенный для применения на химически опасных производствах с целью индивидуальной защиты персонала.

Рис. 15.5. Персональный газоанализатор ПГА-300: а) общий вид; б) электрохимические газовые датчики; в) термокаталитический датчик
В зависимости от вставленных в него электрохимических газовых датчиков (
рис.
15.5, б ) он непрерывно измеряет концентрацию в окружающей среде одновременно двух газов. В комплект сенсора входят откалиброванные электрохимические газовые датчики на кислород, водород,  . По желанию покупателя комплект этот может быть значительно расширен. Датчики легко вынимаются и вставляются в гнезда на корпусе газоанализатора. Каждый из них имеет встроенную флэш-память, в которую записаны параметры его калибровки. После установки в гнездо нового датчика эти данные автоматически считываются микропроцессором и используются при обработке результатов измерения. Измеренные данные выводятся на дисплей и через установленные промежутки времени автоматически записываются и сохраняются в памяти прибора. При необходимости они могут быть переданы через интерфейс во внешний компьютер.
. По желанию покупателя комплект этот может быть значительно расширен. Датчики легко вынимаются и вставляются в гнезда на корпусе газоанализатора. Каждый из них имеет встроенную флэш-память, в которую записаны параметры его калибровки. После установки в гнездо нового датчика эти данные автоматически считываются микропроцессором и используются при обработке результатов измерения. Измеренные данные выводятся на дисплей и через установленные промежутки времени автоматически записываются и сохраняются в памяти прибора. При необходимости они могут быть переданы через интерфейс во внешний компьютер.
Для каждого из контролируемых газов устанавливается и сохраняется в памяти значение допустимой пороговой концентрации, при превышении которого выдается звуковая и/или световая сигнализация. Размеры этого интеллектуального сенсора 160x80x30 мм, масса (с аккумулятором и двумя датчиками) – до 0,3 кг.
15.4.5. Потенциометрические биосенсоры
Оказалось, что при соответствующей модификации электрода или перегородки между электролитами потенциометрические электрохимические сенсоры способны и на большее. С их помощью можно, например, обнаруживать присутствие в контролируемой жидкости и определять концентрацию не только ионов, но и органических молекул, вирусов, микробов. С этой целью для модификации используют природные ферменты – особые органические молекулы, синтезированные и отобранные в ходе биологической эволюции. Они эффективно "распознают" интересующую пользователя молекулу или тело-аналит и содействуют ее химическому взаимодействию с другими ионами или молекулами. Такие вещества, выступающие в роли специфического катализатора, называют еще "энзимами", а сенсоры, в которых используются такие вещества, – " биосенсорами " [ [ 182 ] ].
Одним из первых потенциометрических электрохимических биосенсоров был биосенсор на мочевину [
[
339
]
]. Для этого на мембрану  электрода был осажден фермент уреаза, добываемый из черных бобов. Этот фермент является эффективным катализатором биохимической реакции гидролиза мочевины:
электрода был осажден фермент уреаза, добываемый из черных бобов. Этот фермент является эффективным катализатором биохимической реакции гидролиза мочевины:
 |
( 15.6) |
Поэтому, если в контролируемом растворе присутствует мочевина, то при контакте с иммобилизованной на мембране уреазой она гидролизируется, и в растворе появляются дополнительные ионы  и
и  . Это приводит к изменению
. Это приводит к изменению  раствора, что и позволяет обнаруживать и измерять концентрацию мочевины.
раствора, что и позволяет обнаруживать и измерять концентрацию мочевины.
Еще лучшие результаты дает применение гальванического электрода, чувствительного к ионам  , концентрация которых измеряется непосредственно. С помощью аммоний-селективного электрода обнаруживают и измеряют также концентрации таких важных биохимических веществ, как креатинин (применяя фермент креатиназу), фенилаланин (применяя фермент фенилаланинаммиаклиазу), аденозин (фермент аденозиндезаминаза), аспартам (фермент L-аспартаза) и т.д.
, концентрация которых измеряется непосредственно. С помощью аммоний-селективного электрода обнаруживают и измеряют также концентрации таких важных биохимических веществ, как креатинин (применяя фермент креатиназу), фенилаланин (применяя фермент фенилаланинаммиаклиазу), аденозин (фермент аденозиндезаминаза), аспартам (фермент L-аспартаза) и т.д.
Краткие итоги
Электрохимические сенсоры являются одним из подклассов электрических сенсоров. Но электрические сигналы возникают здесь в системе "электронный проводник - электролит" и являются настолько специфическими, что их обычно выделяют в отдельный класс. Различают следующие виды электрохимических сенсоров: потенциометрические, кондуктометрические (импедансные), амперометрические (кулонометриче-ские), вольтамперометрические и хроноамперометрические.
Важной характеристикой электрохимических сенсоров является их селективность, т.е. способность обнаруживать и откликаться именно на тот вид ионов (или на ту группу ионов), который интересует пользователя. Селективность обеспечивают, во-первых, электродная химическая реакция и свойства перегородки между электролитами. Соединение электролитов в электрохимическом элементе должно обеспечивать возможность переноса электрического заряда, но препятствовать смешиванию электролитов, особенно переносу ионов-аналитов.
Для повышения селективности применяют также такие химические методы, как "модификация" электродов, разбавление исследуемого раствора "  -буфером", "индифферентным раствором" (не содержащем исследуемых ионов, но содержащем мешающие ионы в высокой, заведомо известной концентрации), добавление "комплексонов".
-буфером", "индифферентным раствором" (не содержащем исследуемых ионов, но содержащем мешающие ионы в высокой, заведомо известной концентрации), добавление "комплексонов".
Простейшим потенциометрическим электрохимическим сенсором является " концентрационная ячейка " – электрохимический элемент, в котором оба электрода одинаковы, а электролиты различаются лишь концентрацией в них контролируемых ионов, причем в одном из них концентрация этих ионов известна. Неизвестную концентрацию контролируемых ионов в другом электролите можно определить согласно известному уравнению Нернста по разности потенциалов между электродами.
В настоящее время промышленно выпускают ионоселективные гальванические электроды для обнаружения и измерения концентрации большинства видов ионов в диапазоне от 10–6 до 1 моль/л, а также много видов потенциометрических сенсоров. Они обеспечивают достаточные скорость, точность, низкую стоимость, простоту использования, широко применяются в химической промышленности, в промышленной гальванике, в системах водоснабжения, в экологии и санитарии для контроля за качеством питьевой воды, за стоками предприятий и военных полигонов.
Микропроцессор, введенный в состав потенциометрического сенсора, может взять на себя всю вспомогательную работу, которую при пользовании простыми сенсорами должен выполнять специалист – химик-аналитик. Интеллектуальный потенциометрический сенсор может работать не с одним, а со многими разными ионоселективными электродами как поочередно, так и одновременно – в зависимости от количества входов, на которое он рассчитан. Тогда, опустив в исследуемый раствор десяток разных ионоселективных электродов, можно определить содержимое одновременно десятка разных видов ионов, интересующих пользователя.
Электрохимические сенсоры по изменению концентрации ионов могут обнаруживать присутствие и концентрацию в контролируемой среде также ряда нейтральных молекул. Одним из примеров являются " газочувствительные электроды ", имеющие непроницаемую для электролита, но проницаемую для молекул контролируемых газов мембрану. Проникая сквозь мембрану в электролит, молекулы газа сдвигают динамическое равновесие, вследствие чего изменяется разность потенциалов между электродами.
В потенциометрических биосенсорах для селективного обнаружения и измерения концентрации молекул и микробиологических объектов используют природные ферменты, которые и обеспечивают избирательную реакцию электрохимической ячейки на соответствующий аналит.

