|
Где можно посмотреть информацию о физических ограничениях на значения характеристик компьютеров |
Свойства молекул, лежащие в основе молекулярной элементной базы информатики
Энергетические уровни и оптическое поведение молекул
Молекулы, как и атомы, могут находиться лишь в дискретных "разрешенных" энергетических состояниях. На рис. 3.12 показана типичная схема разрешенных квантовой механикой энергетических состояний молекулы. Вдоль вертикали здесь отложена энергия. Горизонтальными линиями показаны разрешенные энергетические состояния – "уровни энергии".
Уровень "0-0" соответствует "основному" энергетическому состоянию молекулы – наиболее устойчивому, энергетически выгодному, в котором при обычных условиях находится большинство молекул и в который молекула стремится возвратиться после любого возбуждения. В основном состоянии ни один из составляющих атомов не возбужден, а атомы или группы атомов колеблются с небольшими амплитудами относительно друг друга, – это так называемые "нулевые колебания".
Уровень "0-1" – это "первый колебательный уровень", расположенный выше уровня "0-0" на величину  , где
, где 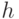 – постоянная Планка, а
– постоянная Планка, а 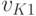 – частота собственных колебаний (первого вида) атомов в молекуле. В зависимости от сложности строения молекулы в ней могут происходить колебания атомов нескольких разных видов. Горизонтальные линии "0-2", "0-3" и т.д. – это энергетические уровни, которые соответствуют колебаниям других видов или более интенсивным колебанием данного вида.
– частота собственных колебаний (первого вида) атомов в молекуле. В зависимости от сложности строения молекулы в ней могут происходить колебания атомов нескольких разных видов. Горизонтальные линии "0-2", "0-3" и т.д. – это энергетические уровни, которые соответствуют колебаниям других видов или более интенсивным колебанием данного вида.
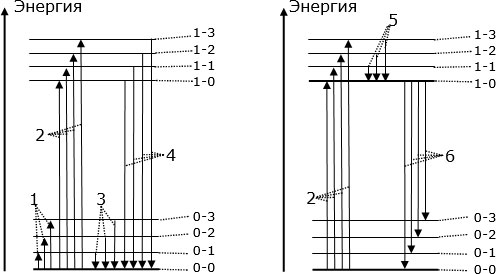
Рис. 3.12. Схема разрешенных стационарных энергетических состояний молекулы и ее оптических энергетических переходов
Горизонтальные линии "1-0", "1-1", "1-2", "1-3" и т.д. соответствуют разрешенным энергетическим состояниям молекулы, когда возбуждена электронная оболочка одного из атомов или одна из молекулярных орбиталей, – тоже при разных типах колебаний атомов.
Молекула имеет также еще более высокие разрешенные энергетические уровни, которые соответствуют более сильным возбуждениям электронных оболочек атомов. Для упрощения они на рисунке не показаны. С этой же целью не показаны также более мелкие энергетические "подуровни", соответствующие крутильным колебаниям атомов вокруг электронных химических связей.
Совокупность всех разрешенных энергетических состояний молекулы называют ее "энергетическим спектром". Каждый вид молекул имеет свой, характерный именно для него, энергетический спектр.
При переходах с одного уровня энергии на другой молекула может поглощать или излучать фотон – квант света. Такие переходы называют "оптическими". Возможность оптического перехода между уровнями определяется квантово-механическими "правилами отбора". При поглощении фотона молекула переходит с нижнего энергетического уровня на более высокий. Молекула поглощает лишь те фотоны, энергия которых равна расстоянию между разрешенными энергетическими уровнями. Например, на рис. 3.12 слева энергетические переходы, обозначенные цифрой 1, соответствуют поглощению фотонов, энергия которых равна разности энергий между уровнями "0-0" и "0-1", "0-0" и "0-2", "0-0" и "0-3" и т.д. Энергетические переходы такого типа предопределяют поглощение света, как правило, в средней инфракрасной (ИК) области спектра. Поэтому структура ИК спектра поглощения отражает структуру колебательного энергетического спектра молекул.
Энергетические переходы, обозначенные цифрой 2, соответствуют поглощению фотонов видимого и ультрафиолетового (УФ) света, энергия которых равна энергиям соответствующих энергетических переходов. Энергия фотонов в этом случае вызывает возбуждение электронной оболочки одного из атомов и частичное возбуждение каких-то видов колебаний атомов.
Если молекула уже находится в одном с возбужденных колебательных состояний "0-1", "0-2", "0-3" и т.д., то она самопроизвольно возвращается в свое основное состояние "0-0" с одновременным излучением фотона соответствующей энергии. При этом энергия колебаний атомов в молекуле скачком уменьшается на соответствующую величину. Такие энергетические переходы обозначены цифрой 3. Переходы, обозначенные цифрой 4, имеют место в случаях, когда электронная оболочка одного из атомов находится в возбужденном состоянии. Возвращаясь в свое основное состояние "0-0", молекула излучает фотон видимого или УФ диапазона света с энергией, которая равна энергии перехода. Спектр излучения свободных молекул по своим частотным характеристикам подобен спектру поглощения тех же молекул.
У целого ряда молекул некоторые возбужденные энергетические состояния оказываются относительно устойчивыми (их называют метастабильными). "Время жизни" молекулы в таких состояниях превышает 10 нс. На рис. 3.12 справа таким относительно устойчивым метастабильным состоянием считается энергетический уровень "1-0". В таком состоянии молекула может оказаться в результате возбуждения. Например, при поглощении возбуждающего света происходят энергетические переходы 2 из основного на высшие энергетические уровни "1-0", "1-1", "1-2", "1-3" и т.д. Большинство из них не являются устойчивыми, и молекула быстро переходит ("скатывается") на метастабильный энергетический уровень "1-0" (стрелки, обозначенные цифрой 5). Но после довольно продолжительного (по сравнению с периодом световых колебаний: 10-15-10–13 с) пребывания в этом состоянии молекула все же возвращается в свое основное состояние "0-0" или на уровни "0-1", "0-2", "0-3", ..., излучая фотоны (стрелки, обозначенные цифрой 6).
Такое излучение, задержанное относительно возбуждения на время, намного превосходящее период световых колебаний, называют люминесценцией.
Если метастабильный уровень является особенно устойчивым, и "время жизни" молекул на нем превышает 10-3-10–2 с, то наблюдается продолжительное "послесвечение" вещества - фосфоресценция. Среднее время "послесвечения" может быть от 1 мс до многих дней. А люминесценцию, задержанную на короткое время, называют флуоресценцией. Для нее среднее время "послесвечения" может быть от 10-8 до 10-3 с.
Люминесценцию молекул характеризуют также квантовым выходом 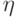 :
:
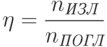 |
( 3.5) |
 фотонов, которые излучаются молекулами, к числу
фотонов, которые излучаются молекулами, к числу 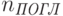 фотонов, которые поглощаются. Квантовый выход редко равен единице, так как почти всегда имеется возможность диссипации энергии возбуждения – перехода ее в тепловую при столкновениях молекул во время хаотического теплового движения. Вероятность диссипации энергии возбуждения может существенно возрастать под действием различных внешних факторов: при повышении температуры среды, при химическом взаимодействии с соседними молекулами, при контакте с металлом, и т.п.
Уменьшение квантового выхода
фотонов, которые поглощаются. Квантовый выход редко равен единице, так как почти всегда имеется возможность диссипации энергии возбуждения – перехода ее в тепловую при столкновениях молекул во время хаотического теплового движения. Вероятность диссипации энергии возбуждения может существенно возрастать под действием различных внешних факторов: при повышении температуры среды, при химическом взаимодействии с соседними молекулами, при контакте с металлом, и т.п.
Уменьшение квантового выхода 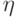 при повышении температуры окружающей среды называют "температурным гашением" люминесценции. Уменьшение
при повышении температуры окружающей среды называют "температурным гашением" люминесценции. Уменьшение 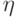 под влиянием химического взаимодействия с определенными молекулами называют "химическим ингибированием", а соответствующие молекулы или группы атомов – "ингибиторами".
под влиянием химического взаимодействия с определенными молекулами называют "химическим ингибированием", а соответствующие молекулы или группы атомов – "ингибиторами".Молекулы с квантовым выходом люминесценции выше 30-50% называют люминофорами (флюорофорами, фосфoрами). Известно довольно много ярких органических и неорганических люминофоров с 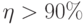 , среди которых можно подобрать люминофор, который излучает свет практически в любой полосе видимого света.
, среди которых можно подобрать люминофор, который излучает свет практически в любой полосе видимого света.
Молекулы могут переходить в возбужденное состояние и на метастабильный уровень не только в результате поглощения света, но и по другим причинам. Возбуждение может быть, например, результатом химических реакций. Тогда излучение называют хемилюминесценцией. В живой природе возбуждение молекул происходит в результате некоторых биохимических реакций. Такое излучение называют биолюминесценцией.
На больших глубинах в морях и океанах биолюминесценция является чуть ли не единственным источником света и одним из важных способов коммуникации живых организмов. Биолюминесценция в большинстве случаев связана с молекулой люциферина, которая возбуждается при окислении.
Взаимодействие молекул
Молекулы могут эффективно взаимодействовать не только с внешним электромагнитным полем, но и между собой.
Молекулы, имеющие дипольный момент, на средних (по атомным меркам) расстояниях взаимодействуют между собой как диполи. Они стараются повернуться в одном и том же направлении – так, чтобы положительный полюс одной молекулы был повернут к отрицательному полюсу другой. При такой ориентации они взаимно притягиваются. Если одна молекула имеет дипольный момент, а в другой молекуле имеются ионы, то молекулы тоже стараются развернуться так, чтобы положительный полюс одной молекулы был повернут к отрицательно заряженному концу другой (или наоборот отрицательный полюс одной молекулы был повернут к положительно заряженному концу другой). В таком положении они тоже взаимно притягиваются. Даже если молекула, имеющая электрический дипольный момент, сближается с молекулой, не имеющей дипольного момента, в последней под воздействием электрического поля диполя происходит поляризация, и молекулы опять-таки начинают взаимно притягиваться.
Общий характер взаимодействия молекул показан на рис. 3.13. Слева вдоль вертикали отложена сила взаимодействия между молекулами, вдоль горизонтали - расстояние между ними.
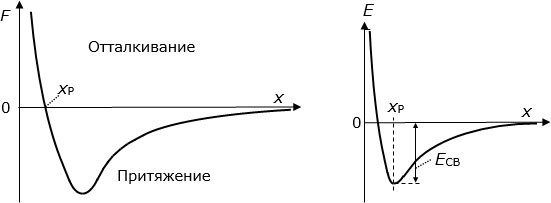
Рис. 3.13. Типичная зависимость силы (слева) и энергии (справа) взаимодействия двух молекул от расстояния между ними
На далеких расстояниях молекулы практически не взаимодействуют. На малых расстояниях начинают взаимно притягиваться (сила считается отрицательной, так как содействует уменьшению расстояния между молекулами). При совсем малых расстояниях, когда их МО начинают заметно перекрываться, молекулы отталкиваются (сила взаимодействия становится положительной). Существует некоторое равновесное расстояние 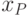 , на котором силы притягивания и отталкивания молекул уравновешиваются.
, на котором силы притягивания и отталкивания молекул уравновешиваются.
Справа на
рис.
3.13 показана зависимость уже не силы, а потенциальной энергии взаимодействия молекул от расстояния между ними. На расстоянии хР наблюдается минимум энергии взаимодействия. И в обычных условиях молекулам выгодно находиться именно в таком связанном состоянии. Этим обусловлено образование межмолекулярных комплексов, капель жидкости, молекулярных кристаллов. Энергию 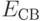 называют энергией связи между молекулами.
называют энергией связи между молекулами.
Связь между молекулами, обусловленная описанным выше взаимодействием дипольных моментов молекул, часто называют связью Ван дер Ваальса.
Частным случаем межмолекулярного взаимодействия является "водородная" связь. Конец молекулы, на котором расположен атом водорода, является положительно заряженным, так как максимум плотности МО находится внутри молекулы между атомом водорода и соседним атомом, и ядро атома водорода – положительно заряженный протон – в значительной мере "обнажен". Поэтому, если рядом находится другая молекула, повернутая к атому водорода своим отрицательно заряженным концом, то возникает сила взаимного притяжения, благодаря которой и может образоваться водородная связь.
Энергия водородной связи (10-40 кДж/моль) значительно меньше, чем энергия ковалентной химической связи атомов в молекуле (200-1000 кДж/моль). Но и такой энергии достаточно, чтобы при комнатных температурах возникали ассоциации молекул. Именно водородная связь предопределяет особенности поведения воды. А в больших органических молекулах, таких, например, как молекулы белков или ДНК, водородная связь обеспечивает взаимодействие одних частей молекулы с другими и "скручивание" молекул.
Когда молекулы сближаются настолько, что их МО начинают перекрываться, становится возможным химическое взаимодействие между молекулами, которое приводит к их перестройке. Многообразие возможных химических взаимодействий между молекулами является огромным. Его уже несколько веков изучает химия.

