|
Где можно посмотреть информацию о физических ограничениях на значения характеристик компьютеров |
Свойства молекул, лежащие в основе молекулярной элементной базы информатики
Молекулярные орбитали
При сближении атомов начинают сильно взаимодействовать лишь внешние атомные орбитали, занятые электронами. Роль внутренних электронных оболочек сводится в основном к тому, что они частично экранируют положительно заряженные ядра атомов, уменьшая силу их кулоновского отталкивания.
В первом приближении считается, что волновые функции  и
и  электронов, соответствующие атомным орбиталям, которые начали перекрываться, суммируются или вычитаются, образуя вместо двух АО две молекулярные орбитали (далее – МО, англ. molecular orbital) с волновыми функциями:
электронов, соответствующие атомным орбиталям, которые начали перекрываться, суммируются или вычитаются, образуя вместо двух АО две молекулярные орбитали (далее – МО, англ. molecular orbital) с волновыми функциями:

Рассмотрим, например, взаимодействие двух атомов водорода (электронная конфигурация каждого из них 1s), условно показанное на
рис.
3.3. Слева показаны два атома водорода до начала взаимодействия: вверху – атомные ядра и размытые электронные облака вокруг них –  -орбитали; внизу – схематическое распределение электронной плотности. Положение атомных ядер показано темными точками. АО почти не перекрываются и не взаимодействуют. В центре показан результат взаимодействия, когда ядра уже сблизились, их АО сильно перекрываются, и волновые функции
-орбитали; внизу – схематическое распределение электронной плотности. Положение атомных ядер показано темными точками. АО почти не перекрываются и не взаимодействуют. В центре показан результат взаимодействия, когда ядра уже сблизились, их АО сильно перекрываются, и волновые функции  -электронов суммируются.
Вокруг ядер атомов возникает общее для них электронное облако – молекулярная орбиталь, имеющая наибольшую плотность между ядрами, которая и стягивает положительно заряженные ядра. Энергия электронов на этой МО оказывается меньше суммы энергий электронов на разрозненных АО. Поэтому эта МО является энергетически выгодной и называется "связывающей" (англ. "bonding") молекулярной орбиталью.
-электронов суммируются.
Вокруг ядер атомов возникает общее для них электронное облако – молекулярная орбиталь, имеющая наибольшую плотность между ядрами, которая и стягивает положительно заряженные ядра. Энергия электронов на этой МО оказывается меньше суммы энергий электронов на разрозненных АО. Поэтому эта МО является энергетически выгодной и называется "связывающей" (англ. "bonding") молекулярной орбиталью.

Рис. 3.3. Слева – атомные орбитали водорода до взаимодействия; в центре – связывающая молекулярная орбиталь; справа – разрыхляющая (антисвязывающая) МО
Справа показан результат взаимодействия в случае, когда волновые функции  -электронов вычитаются. Максимальная плотность электронного облака достигается здесь вне ядер, что способствует электрическому расталкиванию атомов. Такую МО называют "разрыхляющей" или антисвязывающей (англ. "antibonding").
-электронов вычитаются. Максимальная плотность электронного облака достигается здесь вне ядер, что способствует электрическому расталкиванию атомов. Такую МО называют "разрыхляющей" или антисвязывающей (англ. "antibonding").
Образованная молекула водорода 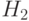 является типичным примером ковалентной химической связи, когда атомы удерживаются вместе в молекуле благодаря общей паре электронов на энергетически выгодной связывающей МО с максимальной плотностью отрицательного электрического заряда между ядрами. Чтобы разъединить атомы, надо затратить определенную энергию, которую называют энергией химической связи.
является типичным примером ковалентной химической связи, когда атомы удерживаются вместе в молекуле благодаря общей паре электронов на энергетически выгодной связывающей МО с максимальной плотностью отрицательного электрического заряда между ядрами. Чтобы разъединить атомы, надо затратить определенную энергию, которую называют энергией химической связи.
Совсем другая картина наблюдается при сближении атомов гелия (электронная конфигурация 1s2). Вокруг ядер здесь находятся по два  -электрона. При образовании молекулярных орбиталей два из них занимают связывающую МО, а другие два вынуждены занять энергетически не выгодную разрыхляющую МО. Из-за этого выигрыш в энергии не достигается, и молекула
-электрона. При образовании молекулярных орбиталей два из них занимают связывающую МО, а другие два вынуждены занять энергетически не выгодную разрыхляющую МО. Из-за этого выигрыш в энергии не достигается, и молекула  не образуется.
не образуется.
Промежуточный случай имеем при взаимодействии атома гелия с атомом водорода. Вместе у них имеются 3 валентных электрона. Два из них занимают связывающую МО, а третий вынужден занять разрыхляющую МО. Достигается небольшой выигрыш в энергии. Поэтому молекула  образуется и может стабильно существовать в определенных условиях. Однако она недостаточно устойчива и, например, при комнатных температурах быстро разваливается.
образуется и может стабильно существовать в определенных условиях. Однако она недостаточно устойчива и, например, при комнатных температурах быстро разваливается.
Устойчивая ковалентная химическая связь между атомами может образоваться только тогда, когда они имеют не полностью заполненные внешние электронные подоболочки.
В некоторых публикациях АО, отличающиеся лишь спиновым квантовым числом, считают одной АО и говорят, что на ней может находиться пара электронов с противоположно ориентированными спинами или один электрон, который называют неспаренным. Тогда говорят, что "ковалентные химические связи между атомами могут образовать лишь неспаренные валентные электроны". Такой взгляд не является точным. Ведь АО, которые отличаются лишь спиновым квантовым числом, являются одинаковыми только при отсутствии внешнего электромагнитного поля. А это – частный случай. Обычно внешние электромагнитные поля всегда имеются (хотя бы магнитное и электрическое поля Земли, электромагнитное поле той среды, в которой находится атом). У электронов в состояниях, отличающихся спиновым квантовым числом, собственные магнитные моменты ориентированы в противоположные стороны. Поэтому с внешним электромагнитным полем они взаимодействуют по-разному, и соответствующие АО деформируются во внешнем поле по-разному. Это уже явно различные атомные орбитали. Электронам на этих орбиталях соответствуют несколько разные значения энергии, – это известные из общего курса физики эффекты Штарка и Зеемана. Следовательно, лучше, точнее с самого начала считать АО, отличающиеся спиновым квантовым числом, разными АО, понимая, что при определенных условиях они могут и не отличаться.
На
рис.
3.4 показаны приблизительные формы связывающих МО, которые образуются при химическом взаимодействии атомов в результате перестройки  - и
- и  - атомных орбиталей. Вверху показан случай, когда взаимодействуют и перестраиваются две
- атомных орбиталей. Вверху показан случай, когда взаимодействуют и перестраиваются две  -орбитали, посредине - случай, когда взаимодействуют и перестраиваются одна
-орбитали, посредине - случай, когда взаимодействуют и перестраиваются одна  - и одна
- и одна  - атомные орбитали, внизу – случай, когда взаимодействуют и перестраиваются две
- атомные орбитали, внизу – случай, когда взаимодействуют и перестраиваются две  -орбитали.
-орбитали.
Рис. 3.4. Приблизительные формы связывающих молекулярных орбиталей, образующихся в результате взаимодействия и перестройки s– и p– атомных орбиталей. Жирными точками указаны положения остова атомов
Если молекула образуется из одинаковых атомов, то общая электронная пара (МО) является симметричной относительно их ядер. Если же молекула образуется из разных атомов, то МО не является симметричной. Плотность МО больше возле того ядра, которое имеет большее сродство с электроном. Например, в молекулах типа  плотность МО значительно больше возле ядра галогена.
плотность МО значительно больше возле ядра галогена.
Молекулярные орбитали при кратных химических связях
Атомы могут объединяться не одной, а двумя или тремя парами общих электронов. Например, два атома азота N (электронная конфигурация  ) объединяются в молекулу с помощью трех пар р-электронов (
рис.
3.5).
) объединяются в молекулу с помощью трех пар р-электронов (
рис.
3.5).
АО, ориентированные вдоль оси ОХ (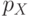 ), проходящей через центры ядер, перекрываются сильнее всего и образуют связывающую молекулярную орбиталь
), проходящей через центры ядер, перекрываются сильнее всего и образуют связывающую молекулярную орбиталь  . АО
. АО  и
и  , ориентированные ортогонально к направлению связи, перекрываются меньше и образуют связывающие молекулярные орбитали
, ориентированные ортогонально к направлению связи, перекрываются меньше и образуют связывающие молекулярные орбитали  и
и  с максимальной плотностью электронного облака вне оси молекулы.
с максимальной плотностью электронного облака вне оси молекулы.
На
рис.
3.5 справа показана лишь  , которая состоит из двух симметричных частей электронного облака – над и под осью ОХ. Аналогично
, которая состоит из двух симметричных частей электронного облака – над и под осью ОХ. Аналогично  , которая для упрощения на рисунке не показана, состоит из двух симметричных частей электронного облака перед и за плоскостью рисунка. Химические связи, образованные парами электронов на молекулярных орбиталях
, которая для упрощения на рисунке не показана, состоит из двух симметричных частей электронного облака перед и за плоскостью рисунка. Химические связи, образованные парами электронов на молекулярных орбиталях  и
и  , заметно слабее, чем химическая связь, образуемая парой электронов на MOX. Темными точками условно показаны "остовы" атомов азота – ядро атома с внутренней электронной оболочкой и
, заметно слабее, чем химическая связь, образуемая парой электронов на MOX. Темными точками условно показаны "остовы" атомов азота – ядро атома с внутренней электронной оболочкой и  -подоболочкой 2-й оболочки. Эти "остовы" практически не изменяются при образовании молекулы азота
-подоболочкой 2-й оболочки. Эти "остовы" практически не изменяются при образовании молекулы азота  .
.
Связывающие МО, в которых максимум электронной плотности достигается на прямой, соединяющей ядра атомов, называют  -связями, а МО, в которых максимум электронной плотности достигается вне этой прямой, –
-связями, а МО, в которых максимум электронной плотности достигается вне этой прямой, –  -связями.
-связями.
В соединениях металлов с неметаллами говорят об "ионном" типе химической связи. По классическим представлениям при этом валентные электроны переходят от атома металла к атому неметалла. Это оказывается энергетически выгодным, поскольку внешние электронные оболочки обоих атомов становятся "заполненными" – как у атомов инертного газа. Образовавшиеся отрицательный и положительный ионы электрически притягиваются, что и создает "ионную связь". Но "классический" взгляд на ионную химическую связь не является точным. На самом деле речь идет лишь о вероятности пребывания валентных электронов возле одного из ионов. Волновая функция валентных электронов, располагающихся в основном возле остова неметалла, не равна нулю также и в окрестности остова атома металла. Но главное то, что максимум плотности МО находится между "остовами" атомов. Т.е. и здесь речь идет об образовании связывающих МО, а ионная связь является частично и ковалентной. Хотя точнее сказать, что ионная связь является идеальным крайним случаем ковалентной, когда плотность МО возле катиона стремится к нулю.
Хотя и принято говорить, что "молекулы состоят из атомов", на самом деле они всегда состоят из положительно заряженных катионов, которые мы выше назвали "остовами", и отрицательно заряженных электронов на молекулярных орбиталях, связывающих эти остовы. Например, молекула азота состоит из двух ионов азота  и трех пар электронов на связывающих МО (
и трех пар электронов на связывающих МО ( ,
,  и
и  ); молекула воды состоит из двух ионов
); молекула воды состоит из двух ионов  (протонов) и одного иона
(протонов) и одного иона  и из двух пар электронов в виде двух связывающих МО.
и из двух пар электронов в виде двух связывающих МО.
Гибридизация атомных орбиталей
Если у атома на внешней электронной оболочке имеются  - и
- и  -электроны, то квантовая механика допускает возможность образования "гибридных"
-электроны, то квантовая механика допускает возможность образования "гибридных"  -орбиталей. Энергия электрона на sр-орбитали немного выше, чем энергия на
-орбиталей. Энергия электрона на sр-орбитали немного выше, чем энергия на  -орбитали, но ниже, чем энергия на
-орбитали, но ниже, чем энергия на  -орбитали. Число образованных гибридных орбиталей всегда равняется числу исходных АО.
-орбитали. Число образованных гибридных орбиталей всегда равняется числу исходных АО.
Например, у атома бериллия ( , электронная конфигурация
, электронная конфигурация  ) на внешней электронной оболочке находятся два
) на внешней электронной оболочке находятся два  -электрона. В таком состоянии атом бериллия не может образовать ковалентные химические связи (поскольку обе
-электрона. В таком состоянии атом бериллия не может образовать ковалентные химические связи (поскольку обе  -орбитали заняты электронами). Однако в комбинации с одной из не занятых
-орбитали заняты электронами). Однако в комбинации с одной из не занятых  -орбиталей при затратах относительно небольшой энергии возможно образование двух гибридных
-орбиталей при затратах относительно небольшой энергии возможно образование двух гибридных  -орбиталей. Их упрощенная форма показана на
рис.
3.6 справа.
-орбиталей. Их упрощенная форма показана на
рис.
3.6 справа.
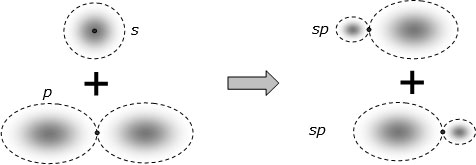
Рис. 3.6. Гибридизация s– и p–орбиталей: слева показаны две исходные, а справа – две сформированные гибридные sр–орбитали
Каждая из этих орбиталей асимметрична, они зеркально симметричны и ориентированы навстречу под углом 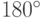 (из-за взаимного кулоновского отталкивания). В таком состоянии атом бериллия (электронная конфигурация
(из-за взаимного кулоновского отталкивания). В таком состоянии атом бериллия (электронная конфигурация  ) становится химически активным и образует связывающие МО, например, с двумя атомами хлора. При этом возникает "линейная" молекула со структурной формулой
) становится химически активным и образует связывающие МО, например, с двумя атомами хлора. При этом возникает "линейная" молекула со структурной формулой  , в которой ковалентные химические связи располагаются вдоль одной прямой.
, в которой ковалентные химические связи располагаются вдоль одной прямой.
У атома бора ( , электронная конфигурация
, электронная конфигурация  ) во время химических реакций при небольших затратах энергии происходит гибридизация одной s-орбитали с двумя
) во время химических реакций при небольших затратах энергии происходит гибридизация одной s-орбитали с двумя  -орбиталями, условно показанная на
рис.
3.7. В результате гибридизации формируются три равноправные АО, которые из-за взаимного кулоновского отталкивания ориентируются в одной плоскости под углами точно
-орбиталями, условно показанная на
рис.
3.7. В результате гибридизации формируются три равноправные АО, которые из-за взаимного кулоновского отталкивания ориентируются в одной плоскости под углами точно  . Поэтому при взаимодействии бора, например, с атомами хлора образуется молекула ВCl3, в которой все три ковалентных химических связи располагаются в одной плоскости под углами
. Поэтому при взаимодействии бора, например, с атомами хлора образуется молекула ВCl3, в которой все три ковалентных химических связи располагаются в одной плоскости под углами  друг к другу.
друг к другу.
У атома кремния ( , электронная конфигурация
, электронная конфигурация  ) при небольших затратах энергии происходит гибридизация одной
) при небольших затратах энергии происходит гибридизация одной  -орбитали с тремя
-орбитали с тремя  -орбиталями, условно показанная на
рис.
3.8.
-орбиталями, условно показанная на
рис.
3.8.
Четыре образованные равноправные гибридные АО из-за взаимного кулоновского отталкивания ориентируются в пространстве под углами  друг к другу. Поэтому при взаимодействии кремния, например, с атомами водорода образуется молекула
друг к другу. Поэтому при взаимодействии кремния, например, с атомами водорода образуется молекула  , в которой четыре ядра водорода размещаются в пространстве в вершинах правильного тетраэдра. Описанные гибридные МО типа
, в которой четыре ядра водорода размещаются в пространстве в вершинах правильного тетраэдра. Описанные гибридные МО типа 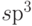 часто называют "тетраэдрическими".
часто называют "тетраэдрическими".
Указанные углы между тетраэдрическими МО могут несколько изменяться, если МО соединяют данный атом с разными атомами. Например, в молекуле  угол между осями МО, связывающих атом кремния с атомом хлора, несколько отличается от углов между осями МО, соединяющих атом кремния с атомами водорода.
угол между осями МО, связывающих атом кремния с атомом хлора, несколько отличается от углов между осями МО, соединяющих атом кремния с атомами водорода.


